- HALOGÈNES
- HALOGÈNESÉléments chimiques constituant le sous-groupe VII b de la classification périodique, les halogènes sont au nombre de cinq: le fluor (F), le chlore (Cl), le brome (Br), l’iode (I) et l’astate (At); précédant immédiatement chacun des gaz inertes – sauf l’hélium –, ils possèdent 7 électrons de valence et présentent un caractère électronégatif et oxydant très accusé lié à leur tendance à capter un électron pour saturer leurs orbitales de valence à 8 électrons, soit en formant des ions halogénures comme Cl-, soit en établissant des liens de covalence.L’identité des structures électroniques (ns 2, np 5, avec n = 2, 3, 4, 5 et 6 respectivement pour F, Cl, Br, I et At) et la forte électronégativité confèrent à cette famille chimique une grande homogénéité qui ne peut être comparée qu’à celle des gaz inertes et des métaux alcalins. À l’état élémentaire, les atomes sont associés en molécules diatomiques, fait qui explique la grande volatilité des halogènes. Corps simples très réactifs, ils sont susceptibles de former des composés avec presque tous les autres éléments.Si l’on excepte l’astate – dont les isotopes sont tous artificiels et ont des vies moyennes de quelques heures au maximum –, la multitude de composés organiques ou minéraux auxquels les halogènes prennent part, leur relative diffusion dans l’écorce terrestre, leurs nombreuses applications à l’état simple ou combiné en font des éléments très importants.On désigne par « pseudohalogènes » des groupements d’atomes de non-métaux, comme le cyanogène (CN)2 et le thiocyanogène (SCN)2, qui ont en commun avec les halogènes un grand nombre de propriétés, en particulier l’aptitude à former des molécules dimères et le caractère oxydant. De plus, les espèces réduites (CN- et SC-) sont chimiquement très proches des ions halogénures ; l’ion cyanure C- possède au plus haut degré la propriété de former des complexes très stables avec les ions d’éléments de transition.1. État naturel et isolementTrès réactifs, les halogènes ne sont rencontrés dans la nature qu’à l’état combiné sous forme d’halogénures ou de sels complexes cristallisés ou dissous; fluor et chlore sont particulièrement abondants dans l’écorce terrestre; brome et iode sont plus rares (tabl. 1). Chlore, brome et iode, qui forment avec les éléments métalliques abondants des halogénures solubles, se sont concentrés dans les mers actuelles ou fossiles où ils constituent des gisements importants, tels ceux d’Alsace et de Stassfurt (Allemagne). Par contre, le fluor forme avec le calcium des composés peu solubles, ce qui explique sa teneur relativement faible dans l’eau de mer; ses principaux minerais sont la fluorine (ou fluorite) Ca2, la fluorapatite Ca5F(PO4)3 et la cryolite Na3Al6.Les corps simples résultent de l’oxydation des ions halogénures suivant la réaction:
 industriellement, cette réaction est réalisée par voie électrolytique, pour le chlore à partir du chlorure de sodium dissous dans l’eau ou fondu, et pour le fluor par oxydation anodique du fluorure d’hydrogène anhydre additionné de fluorure de potassium.Dans le cas des ions bromure Br-, on utilise une oxydation chimique par le chlore gazeux:
industriellement, cette réaction est réalisée par voie électrolytique, pour le chlore à partir du chlorure de sodium dissous dans l’eau ou fondu, et pour le fluor par oxydation anodique du fluorure d’hydrogène anhydre additionné de fluorure de potassium.Dans le cas des ions bromure Br-, on utilise une oxydation chimique par le chlore gazeux: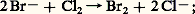 on traite de cette manière les eaux mères des chlorures alcalins, résidus de l’extraction des sels abondants dans les marais salants et les gisements salins, ou directement l’eau de mer naturelle; le brome formé est entraîné sous forme de vapeur par un courant d’air ou de vapeur d’eau.Les besoins mondiaux en iode – plusieurs milliers de tonnes par an – sont pratiquement satisfaits par les dépôts abondants de salpêtre du Chili, exploités principalement pour le nitrate de sodium; les eaux résiduaires résultant de l’extraction de celui-ci contiennent environ 3 kg . m-3 d’iodate de sodium NaI3. Les procédés utilisés pour isoler l’iode mettent en jeu la réduction de l’ion I-3 par le sulfite de sodium à pH convenable:
on traite de cette manière les eaux mères des chlorures alcalins, résidus de l’extraction des sels abondants dans les marais salants et les gisements salins, ou directement l’eau de mer naturelle; le brome formé est entraîné sous forme de vapeur par un courant d’air ou de vapeur d’eau.Les besoins mondiaux en iode – plusieurs milliers de tonnes par an – sont pratiquement satisfaits par les dépôts abondants de salpêtre du Chili, exploités principalement pour le nitrate de sodium; les eaux résiduaires résultant de l’extraction de celui-ci contiennent environ 3 kg . m-3 d’iodate de sodium NaI3. Les procédés utilisés pour isoler l’iode mettent en jeu la réduction de l’ion I-3 par le sulfite de sodium à pH convenable: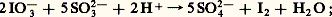 l’iode formé précipite à l’état solide: on le sépare par filtration, on le purifie ensuite par sublimation.2. Propriétés physiquesLes isotopes naturels des halogènes possèdent des nombres de masse impairs (tabl. 2).À l’état élémentaire, les atomes se groupent par paires en établissant une liaison de covalence. Les liaisons intermoléculaires sont faibles aux états solide et liquide; il en résulte des températures de fusion et d’ébullition relativement basses; celles-ci augmentent toutefois avec la masse moléculaire. Dans les conditions normales, le fluor et le chlore sont des gaz légèrement colorés en jaune-vert, le brome est un liquide dense rouge foncé, l’iode est un solide gris d’éclat métallique émettant par léger chauffage une vapeur violette.Si le chlore et le brome sont notablement solubles dans l’eau, la solubilité de l’iode est très faible; elle est toutefois fortement augmentée – dans un rapport de plusieurs milliers – en présence d’un iodure soluble, par suite de la formation d’ions poly-iodures comme I-3:
l’iode formé précipite à l’état solide: on le sépare par filtration, on le purifie ensuite par sublimation.2. Propriétés physiquesLes isotopes naturels des halogènes possèdent des nombres de masse impairs (tabl. 2).À l’état élémentaire, les atomes se groupent par paires en établissant une liaison de covalence. Les liaisons intermoléculaires sont faibles aux états solide et liquide; il en résulte des températures de fusion et d’ébullition relativement basses; celles-ci augmentent toutefois avec la masse moléculaire. Dans les conditions normales, le fluor et le chlore sont des gaz légèrement colorés en jaune-vert, le brome est un liquide dense rouge foncé, l’iode est un solide gris d’éclat métallique émettant par léger chauffage une vapeur violette.Si le chlore et le brome sont notablement solubles dans l’eau, la solubilité de l’iode est très faible; elle est toutefois fortement augmentée – dans un rapport de plusieurs milliers – en présence d’un iodure soluble, par suite de la formation d’ions poly-iodures comme I-3: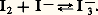 Cette complexation de l’iode est réversible; elle est mise à profit pour préparer des « solutions d’iode » relativement concentrées utilisées comme oxydant en chimie analytique.Le fluor par contre, attaque l’eau chimiquement à la température ordinaire:
Cette complexation de l’iode est réversible; elle est mise à profit pour préparer des « solutions d’iode » relativement concentrées utilisées comme oxydant en chimie analytique.Le fluor par contre, attaque l’eau chimiquement à la température ordinaire: 3. Caractère oxydant; halogénuresDans leurs réactions avec les autres éléments et leurs composés, les halogènes manifestent généralement un fort caractère électronégatif, c’est-à-dire une tendance marquée à leur arracher des électrons pour former des ions -, Cl-, Br- ou I-. C’est le fluor qui possède cette propriété au plus haut degré, le caractère électronégatif des halogènes plus lourds diminuant progressivement. Les réactions sont particulièrement violentes avec les éléments métalliques comme le sodium, le magnésium, le fer, qui brûlent dans les halogènes gazeux en formant des halogénures:
3. Caractère oxydant; halogénuresDans leurs réactions avec les autres éléments et leurs composés, les halogènes manifestent généralement un fort caractère électronégatif, c’est-à-dire une tendance marquée à leur arracher des électrons pour former des ions -, Cl-, Br- ou I-. C’est le fluor qui possède cette propriété au plus haut degré, le caractère électronégatif des halogènes plus lourds diminuant progressivement. Les réactions sont particulièrement violentes avec les éléments métalliques comme le sodium, le magnésium, le fer, qui brûlent dans les halogènes gazeux en formant des halogénures: Les halogénures des métaux très réducteurs comme les alcalins (sodium, potassium) ou les alcalino-terreux (magnésium, calcium) sont des solides blancs bien cristallisés, aux points de fusions élevés, et dont les structures sont constituées d’un agrégat tridimensionnel d’anions et de cations liés par des forces électrostatiques. Les éléments de transition donnent également des halogénures ioniques, mais seulement aux degrés d’oxydation peu élevés; leurs colorations dépendent à la fois de la nature de l’ion métallique et de l’halogène qui lui est associé.Les halogénures des métaux sont généralement solubles dans l’eau, sauf les fluorures de plomb et des alcalino-terreux, les iodures PbI2 et HgI2, et les halogénures d’argent AgCl, AgBr et AgI, dont la formation constitue un critère d’identification des halogènes; par contre, le fluorure d’argent AgF est très soluble.Un aspect curieux et moderne de la chimie des halogénures a fait l’objet de recherches intensives: il s’agit des clusters . Dans certains halogénures d’éléments de transition lourds (tels Nb6Br12, Re3Cl9), l’élément de transition semble être à un degré d’oxydation bas, quelquefois fractionnaire (comme dans Nb615 et Ta6I14). En réalité, l’étude détaillée des structures cristallines a révélé que les atomes métalliques se réunissaient par 3 ou 6 en constituant des grappes (traduction de l’anglais clusters ) par l’intermédiaire de liaisons directes rappelant celles observées dans les métaux eux-mêmes; des atomes d’halogènes établissent des liaisons supplémentaires constituant avec le groupe d’atomes métalliques un gros cation (fig. 1).Ces composés sont solubles et recristallisables dans les solutions aqueuses acides, mais sont oxydés par l’eau en solution alcaline avec dégagement d’hydrogène.Beaucoup de non-métaux réagissent également avec les halogènes; l’arsenic pulvérulent, par exemple, s’enflamme spontanément dans le chlore:
Les halogénures des métaux très réducteurs comme les alcalins (sodium, potassium) ou les alcalino-terreux (magnésium, calcium) sont des solides blancs bien cristallisés, aux points de fusions élevés, et dont les structures sont constituées d’un agrégat tridimensionnel d’anions et de cations liés par des forces électrostatiques. Les éléments de transition donnent également des halogénures ioniques, mais seulement aux degrés d’oxydation peu élevés; leurs colorations dépendent à la fois de la nature de l’ion métallique et de l’halogène qui lui est associé.Les halogénures des métaux sont généralement solubles dans l’eau, sauf les fluorures de plomb et des alcalino-terreux, les iodures PbI2 et HgI2, et les halogénures d’argent AgCl, AgBr et AgI, dont la formation constitue un critère d’identification des halogènes; par contre, le fluorure d’argent AgF est très soluble.Un aspect curieux et moderne de la chimie des halogénures a fait l’objet de recherches intensives: il s’agit des clusters . Dans certains halogénures d’éléments de transition lourds (tels Nb6Br12, Re3Cl9), l’élément de transition semble être à un degré d’oxydation bas, quelquefois fractionnaire (comme dans Nb615 et Ta6I14). En réalité, l’étude détaillée des structures cristallines a révélé que les atomes métalliques se réunissaient par 3 ou 6 en constituant des grappes (traduction de l’anglais clusters ) par l’intermédiaire de liaisons directes rappelant celles observées dans les métaux eux-mêmes; des atomes d’halogènes établissent des liaisons supplémentaires constituant avec le groupe d’atomes métalliques un gros cation (fig. 1).Ces composés sont solubles et recristallisables dans les solutions aqueuses acides, mais sont oxydés par l’eau en solution alcaline avec dégagement d’hydrogène.Beaucoup de non-métaux réagissent également avec les halogènes; l’arsenic pulvérulent, par exemple, s’enflamme spontanément dans le chlore: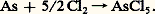 Les halogénures formés sont moléculaires, et de ce fait présentent des températures d’ébullition relativement basses; on doit admettre que le transfert d’électron de l’élément sur l’halogène n’est pas total et que les liaisons qui s’établissent sont d’un type covalent et dirigé; la géométrie des molécules dépend étroitement du nombre d’électrons de l’élément et des orbitales atomiques dont il dispose (fig. 2).Ces composés sont attaqués par l’eau avec formation d’halogénure d’hydrogène, réactions d’hydrolyse souvent violentes dès la température ordinaire:
Les halogénures formés sont moléculaires, et de ce fait présentent des températures d’ébullition relativement basses; on doit admettre que le transfert d’électron de l’élément sur l’halogène n’est pas total et que les liaisons qui s’établissent sont d’un type covalent et dirigé; la géométrie des molécules dépend étroitement du nombre d’électrons de l’élément et des orbitales atomiques dont il dispose (fig. 2).Ces composés sont attaqués par l’eau avec formation d’halogénure d’hydrogène, réactions d’hydrolyse souvent violentes dès la température ordinaire: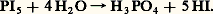 L’action de l’hydrogène sur les halogènes conduit à la formation d’halogénures d’hydrogène , composés gazeux d’odeur acide:
L’action de l’hydrogène sur les halogènes conduit à la formation d’halogénures d’hydrogène , composés gazeux d’odeur acide: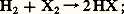 la comparaison des conditions de réaction permet d’apprécier les réactivités des halogènes: spontanée et explosive avec le fluor, même aux basses températures, elle doit être amorcée dans le cas du chlore, par exemple à l’aide d’un rayonnement ultraviolet; avec le brome elle devient plus difficile et nécessite un chauffage au-dessus de 600 0C; quant à l’iode, il donne lieu à une réaction équilibrée à cause de l’instabilité de l’iodure d’hydrogène formé qui de ce fait est un réducteur énergique.Les halogénures d’hydrogène sont des gaz incolores et très solubles dans l’eau: leurs solutions sont communément appelées acides fluorhydrique, chlorhydrique, bromhydrique et iodhydrique. En réalité, les molécules HCl, HBr et HI se dissocient entièrement en cédant leur proton au solvant:
la comparaison des conditions de réaction permet d’apprécier les réactivités des halogènes: spontanée et explosive avec le fluor, même aux basses températures, elle doit être amorcée dans le cas du chlore, par exemple à l’aide d’un rayonnement ultraviolet; avec le brome elle devient plus difficile et nécessite un chauffage au-dessus de 600 0C; quant à l’iode, il donne lieu à une réaction équilibrée à cause de l’instabilité de l’iodure d’hydrogène formé qui de ce fait est un réducteur énergique.Les halogénures d’hydrogène sont des gaz incolores et très solubles dans l’eau: leurs solutions sont communément appelées acides fluorhydrique, chlorhydrique, bromhydrique et iodhydrique. En réalité, les molécules HCl, HBr et HI se dissocient entièrement en cédant leur proton au solvant: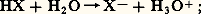 de ce fait leurs solutions aqueuses possèdent les propriétés d’un acide fort. Par contre, l’acide fluorhydrique HF est un acide faible qui présente la particularité de donner par action d’une base des sels acides à demi-neutralisation, tel K (HF2):
de ce fait leurs solutions aqueuses possèdent les propriétés d’un acide fort. Par contre, l’acide fluorhydrique HF est un acide faible qui présente la particularité de donner par action d’une base des sels acides à demi-neutralisation, tel K (HF2):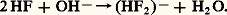 Les solutions fluorhydriques possèdent de plus la propriété d’attaquer le verre et les silicates; en solution étendue, il se forme de l’acide fluosilicique:
Les solutions fluorhydriques possèdent de plus la propriété d’attaquer le verre et les silicates; en solution étendue, il se forme de l’acide fluosilicique: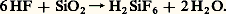 Des réactions de substitution d’halogènes telles que:
Des réactions de substitution d’halogènes telles que: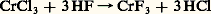 sont énergétiquement possibles parce que l’un des produits formés (ici le fluorure de chrome) associe l’élément le plus électropositif (le chrome) et l’élément le plus électronégatif (le fluor).4. Composés oxygénésÀ cause de leur caractère électronégatif, les halogènes présentent dans les halogénures le degré d’oxydation formel 漣 1; ils sont susceptibles d’acquérir des degrés d’oxydation positifs si on les associe à un élément plus électronégatif qu’eux-mêmes, comme l’oxygène. Cette remarque ne s’applique pas au fluor, le plus électronégatif de tous les éléments, mais seulement au chlore, au brome et à l’iode, dont les principaux degrés d’oxydation positifs sont: I, III, IV, V et VII, ce dernier correspondant à la mobilisation de la totalité des électrons de valence.Les espèces oxydées sont électriquement neutres – comme le bioxyde de chlore Cl2 (ClIV), le pentoxyde d’iode I25 (IV) – ou ce sont des ions négatifs (fig. 3) – comme l’ion chlorate Cl-3 (CIV) ou l’ion paraperiodate I65- (IVII). Ces anions sont associés à des cations alcalins, alcalino-terreux ou à Ag+ dans des composés salins, ou bien à des protons dans les acides correspondants, HCl3 et H5I6.Sauf I25, les oxydes d’halogènes sont de formation endoénergétique; leur préparation à partir des éléments exige donc un apport d’énergie qui peut être fourni par l’effluve électrique (O22, Br2). Certains anhydrides d’acides, tels Cl27 et I25, sont obtenus en déshydratant les acides correspondants, HCl4 et HI3. Mais le plus souvent on a recours aux nombreuses réactions de dismutation que subissent les degrés d’oxydation intermédiaires; les halogènes eux-mêmes se dismutent en solution basique:
sont énergétiquement possibles parce que l’un des produits formés (ici le fluorure de chrome) associe l’élément le plus électropositif (le chrome) et l’élément le plus électronégatif (le fluor).4. Composés oxygénésÀ cause de leur caractère électronégatif, les halogènes présentent dans les halogénures le degré d’oxydation formel 漣 1; ils sont susceptibles d’acquérir des degrés d’oxydation positifs si on les associe à un élément plus électronégatif qu’eux-mêmes, comme l’oxygène. Cette remarque ne s’applique pas au fluor, le plus électronégatif de tous les éléments, mais seulement au chlore, au brome et à l’iode, dont les principaux degrés d’oxydation positifs sont: I, III, IV, V et VII, ce dernier correspondant à la mobilisation de la totalité des électrons de valence.Les espèces oxydées sont électriquement neutres – comme le bioxyde de chlore Cl2 (ClIV), le pentoxyde d’iode I25 (IV) – ou ce sont des ions négatifs (fig. 3) – comme l’ion chlorate Cl-3 (CIV) ou l’ion paraperiodate I65- (IVII). Ces anions sont associés à des cations alcalins, alcalino-terreux ou à Ag+ dans des composés salins, ou bien à des protons dans les acides correspondants, HCl3 et H5I6.Sauf I25, les oxydes d’halogènes sont de formation endoénergétique; leur préparation à partir des éléments exige donc un apport d’énergie qui peut être fourni par l’effluve électrique (O22, Br2). Certains anhydrides d’acides, tels Cl27 et I25, sont obtenus en déshydratant les acides correspondants, HCl4 et HI3. Mais le plus souvent on a recours aux nombreuses réactions de dismutation que subissent les degrés d’oxydation intermédiaires; les halogènes eux-mêmes se dismutent en solution basique: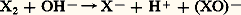 avec X = Cl, Br, et
avec X = Cl, Br, et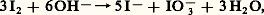 réactions qui sont d’ailleurs totalement inversées en milieu acide, ce qui justifie les considérations précédentes sur la solubilité de ces halogènes dans l’eau. Le bioxyde de chlore Cl2 est préparé, sous la forme d’un gaz jaune-vert, par action d’acide sulfurique concentré sur le chlorate de potassium KCl3; l’acide HCl3 libéré primairement se décompose sous l’action de l’acide sulfurique:
réactions qui sont d’ailleurs totalement inversées en milieu acide, ce qui justifie les considérations précédentes sur la solubilité de ces halogènes dans l’eau. Le bioxyde de chlore Cl2 est préparé, sous la forme d’un gaz jaune-vert, par action d’acide sulfurique concentré sur le chlorate de potassium KCl3; l’acide HCl3 libéré primairement se décompose sous l’action de l’acide sulfurique: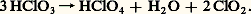 On utilise aussi l’action des halogènes sur les oxydants forts comme les chlorates ou l’acide nitrique:
On utilise aussi l’action des halogènes sur les oxydants forts comme les chlorates ou l’acide nitrique: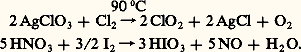 Instables, les oxydes d’halogènes se décomposent avec explosion sous l’effet d’un choc ou d’un léger chauffage; ce sont des oxydants puissants, de même que les oxyacides qu’ils forment et leurs sels. Les chlorates alcalins comme KCl3 libèrent leur oxygène par chauffage brutal à 500 0C en laissant un résidu de chlorure alcalin et forment avec le soufre et le carbone des mélanges détonant au choc; l’anhydride iodique I25 oxyde le monoxyde de carbone dès 70 0C, réaction utilisée pour doser ce dernier dans les mélanges gazeux:
Instables, les oxydes d’halogènes se décomposent avec explosion sous l’effet d’un choc ou d’un léger chauffage; ce sont des oxydants puissants, de même que les oxyacides qu’ils forment et leurs sels. Les chlorates alcalins comme KCl3 libèrent leur oxygène par chauffage brutal à 500 0C en laissant un résidu de chlorure alcalin et forment avec le soufre et le carbone des mélanges détonant au choc; l’anhydride iodique I25 oxyde le monoxyde de carbone dès 70 0C, réaction utilisée pour doser ce dernier dans les mélanges gazeux: L’instabilité des sels oxyhalogénés est surtout importante pour les composés de degrés d’oxydation intermédiaires, qui manifestent une forte tendance à la dismutation par simple chauffage. Si le chauffage est conduit avec précautions, le dernier terme des dismutations avant la décomposition totale en oxygène et halogénure est le composé de degré d’oxydation VII (perchlorate ou paraperiodate), qui se révèle ainsi le moins instable:
L’instabilité des sels oxyhalogénés est surtout importante pour les composés de degrés d’oxydation intermédiaires, qui manifestent une forte tendance à la dismutation par simple chauffage. Si le chauffage est conduit avec précautions, le dernier terme des dismutations avant la décomposition totale en oxygène et halogénure est le composé de degré d’oxydation VII (perchlorate ou paraperiodate), qui se révèle ainsi le moins instable: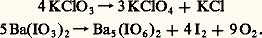 Les acides correspondants, l’acide perchlorique HCl4 et l’acide paraperiodique H5I6, présentent également une certaine stabilité. Le premier ne manifeste pas son caractère oxydant à froid et en solution aqueuse; celle-ci, par exemple, réagit sur un métal réducteur comme le zinc uniquement par ses protons:
Les acides correspondants, l’acide perchlorique HCl4 et l’acide paraperiodique H5I6, présentent également une certaine stabilité. Le premier ne manifeste pas son caractère oxydant à froid et en solution aqueuse; celle-ci, par exemple, réagit sur un métal réducteur comme le zinc uniquement par ses protons: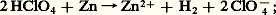 l’acide perchlorique est d’ailleurs un acide très fort complètement dissocié dans l’eau.5. PseudohalogènesLes pseudohalogènes n’ont pas tous été préparés à l’état libre, mais leurs formes réduites, qui sont les homologues des ions halogénures, sont mieux connues. Les ions pseudohalogénures les plus importants sont l’ion cyanure C-, l’ion thiocyanate SC-, l’ion cyanate OC- et l’ion azoture -3; l’association des atomes qui les constituent est de nature covalente, avec participation de liaisons 靖 et 神. Ces anions sont le plus souvent associés à des cations alcalins sous la forme de composés salins comme le cyanure de sodium NaCN; les acides correspondants, contrairement à HCl, HBr et HI, sont faiblement dissociés en solution aqueuse, mais les pseudohalogénures d’argent ont en commun avec AgCl, AgBr et AgI leur caractère insoluble.Les cyanures alcalins sont très stables, ce qu’on interprète en observant que l’ion C- a même structure électronique que la molécule d’azote 2, qui est particulièrement, inerte. Le cyanure de sodium, à cause de ses nombreuses applications – extraction de l’or, bains de galvanoplastie, photographie – fait l’objet d’une industrie importante; sa synthèse passe généralement par un dérivé du carbure de calcium, la cyanamide calcique Ca(CN2), que l’on convertit en présence d’un réducteur et d’un sel de sodium:
l’acide perchlorique est d’ailleurs un acide très fort complètement dissocié dans l’eau.5. PseudohalogènesLes pseudohalogènes n’ont pas tous été préparés à l’état libre, mais leurs formes réduites, qui sont les homologues des ions halogénures, sont mieux connues. Les ions pseudohalogénures les plus importants sont l’ion cyanure C-, l’ion thiocyanate SC-, l’ion cyanate OC- et l’ion azoture -3; l’association des atomes qui les constituent est de nature covalente, avec participation de liaisons 靖 et 神. Ces anions sont le plus souvent associés à des cations alcalins sous la forme de composés salins comme le cyanure de sodium NaCN; les acides correspondants, contrairement à HCl, HBr et HI, sont faiblement dissociés en solution aqueuse, mais les pseudohalogénures d’argent ont en commun avec AgCl, AgBr et AgI leur caractère insoluble.Les cyanures alcalins sont très stables, ce qu’on interprète en observant que l’ion C- a même structure électronique que la molécule d’azote 2, qui est particulièrement, inerte. Le cyanure de sodium, à cause de ses nombreuses applications – extraction de l’or, bains de galvanoplastie, photographie – fait l’objet d’une industrie importante; sa synthèse passe généralement par un dérivé du carbure de calcium, la cyanamide calcique Ca(CN2), que l’on convertit en présence d’un réducteur et d’un sel de sodium: On prépare les pseudohalogènes en faisant subir aux ions correspondants une oxydation ménagée; dans le cas du cyanogène, on peut utiliser un sel cuivrique, qui oxyde C- en solution aqueuse:
On prépare les pseudohalogènes en faisant subir aux ions correspondants une oxydation ménagée; dans le cas du cyanogène, on peut utiliser un sel cuivrique, qui oxyde C- en solution aqueuse: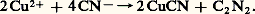 Les pseudohalogènes connus sont des substances volatiles résultant de la combinaison symétrique de deux radicaux; le cyanogène, par exemple, a la structure:
Les pseudohalogènes connus sont des substances volatiles résultant de la combinaison symétrique de deux radicaux; le cyanogène, par exemple, a la structure: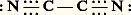 Les cyanures possèdent à un plus haut degré que les ions halogénures la propriété de former des complexes de coordination extrêmement stables avec les éléments de transition. La liaison se fait par l’intermédiaire de l’atome de carbone, qui cède un doublet électronique à l’ion de transition; avec l’argent et l’or monovalents, les complexes sont linéaires:
Les cyanures possèdent à un plus haut degré que les ions halogénures la propriété de former des complexes de coordination extrêmement stables avec les éléments de transition. La liaison se fait par l’intermédiaire de l’atome de carbone, qui cède un doublet électronique à l’ion de transition; avec l’argent et l’or monovalents, les complexes sont linéaires: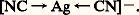 L’affinité de l’or pour les ions cyanures est si grande qu’il perd en leur présence son caractère de métal noble; il s’oxyde à l’air en donnant un complexe soluble:
L’affinité de l’or pour les ions cyanures est si grande qu’il perd en leur présence son caractère de métal noble; il s’oxyde à l’air en donnant un complexe soluble: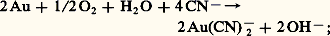 cette réaction est à la base du principal procédé d’extraction de l’or.Les cyanures et l’acide cyanhydrique sont des toxiques extrêmement violents; ils doivent leur nocivité à une complexation du fer par C- dans la molécule d’hémoglobine, inhibant ainsi le phénomène de respiration.
cette réaction est à la base du principal procédé d’extraction de l’or.Les cyanures et l’acide cyanhydrique sont des toxiques extrêmement violents; ils doivent leur nocivité à une complexation du fer par C- dans la molécule d’hémoglobine, inhibant ainsi le phénomène de respiration.
Encyclopédie Universelle. 2012.
